La materia es todo aquello que tiene masa y que, por lo tanto, ocupa un volumen.Desde hace muchos años, una de las grandes preocupaciones de los científicos ha sido poder conocer la constitución de la materia para poder llegar a predecir su comportamiento.Los avances experimentales y teóricos del siglo XX han permitido conocer mejor la estructura interna de la materia. Ahora sabemos que toda materia está formada por un conjunto de átomos que, a su vez, están constituidos por las llamadas partículas subatómicas: los electrones, los protones y los neutrones (principalmente). En los átomos que forman la materia se pueden distinguir dos partes:El núcleo, que es la parte central del átomo y que ocupa una parte muy pequeña. En su interior se encuentran los protones y los neutrones, entre otras partículas subátomicas.La corteza, que es la parte exterior del átomo y ocupa la mayor parte de su volumen. Esta parte está formada por un único tipo de partículas subatómicas, los electrones que se mueven a una gran velocidad alrededor del núcleo, describiendo unas trayectorias elípticas llamadas órbitas.
Descubrimiento del electronLos científicos utilizaban la electricidad mucho antes de comprender cómo funcionaba realmente. Fue J.J. Thomson quien decidió investigar al respecto en el año 1897. Utilizó rayos catódicos para realizar los experimentos en campos eléctricos y magnéticos. Allí se dio cuenta que los rayos se componen de pequeñas partículas más pequeñas que los átomos, que él llamó “corpúsculos”, y que según él, carecían de interés para cualquier persona relacionada con la física.¿Cómo se dio cuenta de ello? Cuando una descarga eléctrica se manda en un tubo de vacío, se ven un resplandor verde fosforescente. Entonces, Thomson decidió meter dentro una cruz de mica, apreciando que cuando circulaba la electricidad por el tubo, se producía una sombra perfecta en forma de cruz, lo que significa que algo viajaba en línea recta y se veía detenido por la mica.
El descubrimiento del protón
De esta forma, la balanza se inclinó hacia el punto de vista de los científicos ingleses, que decían que los rayos eran cuerpos negativamente electrizados disparados a gran velocidad; en detrimento de la opinión alemana que decía que eran un tipo de vibración.Por esa época, era impensable pensar que el átomo pudiera tener partículas más pequeñas dentro, ya que se lo consideraba como una unidad indivisible que era el fundamento de la materia. Sin embargo, a los experimentos de Thomson se unieron los de muchos científicos de Reino Unido, Alemania y Francia que decidieron investigar sobre estas partículas de carga negativa llamados electrones.Poco tiempo después, se dieron cuenta de que la corriente eléctrica no es nada más ni nada menos que estos corpúsculos -los electrones- moviéndose, lo que le hizo cobrar importancia a esta pequeña partícula. El físico alemán E. Goldstein realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre derayos canales.
El estudio de estos rayos determinó que estaban formados por partículas de carga positiva y que tenían una masa distinta según cual fuera el gas que estaba encerrado en el tubo. Esto aclaró que las partículas salían del seno del gas y no del electrodo positivo.
Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva o protón, cuya carga es la misma que la del electrón pero positiva y su masa es 1837 veces mayor
El nuevo modelo
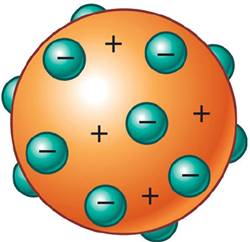
Thomson prpuso un modelo en la cual la parte positiva del atomo se hallba distribuida uniformemente por todo el volumen de este , mientras los electrones se hallban inmersos en esta matriz de protones , como las pasas en un pudin. Ademas, planteaba que la cantidad de cargas positivas y negativas presentes eran iguales , con lo cual el atomo era esencialmente una entidad neutra
Fuentes.- 1:Libro Ministerio de educación ecuador 1 año de bachillerato santillana
2:http://www.endesaeduca.com/Endesa_educa/recursos-interactivos/conceptos-basicos/ii.-la-naturaleza-electrica-de-la-materia
3:http://www.batanga.com/curiosidades/2010/10/19/como-se-descubrio-el-electron

No hay comentarios:
Publicar un comentario